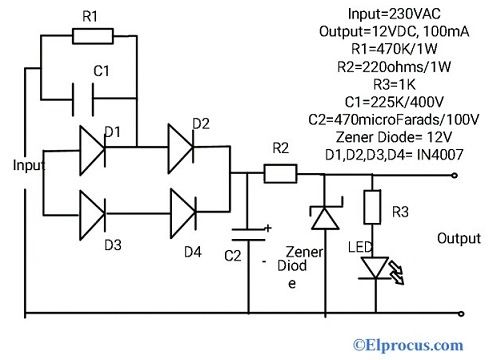
Una celda seca es la forma más simple de fuente de producción de electricidad. Varias celdas combinadas celdas juntas forman una batería. los plomo-ácido o níquel-cadmio batería es la versión avanzada de celda seca. Esta celda fue inventada por primera vez por el ingeniero francés Georges Leclanche en el año 1866. Su invención lleva el nombre de su nombre como batería Leclanche. Pero en ese momento, era muy pesado y se podía romper fácilmente. Una celda seca tiene el mismo principio y es la versión avanzada de la batería Leclanche y viene en diferentes voltajes y tamaños. La forma comercial de la celda de zinc-carbono, que es la forma modificada de la batería Leclanche, fue inventada en 1881 por Carl Gassner de Mainz. Se produce en grandes cantidades y se utiliza en muchas aplicaciones como juguetes, radios, calculadoras, etc.
¿Qué es una celda seca?
Una celda seca es un dispositivo que genera electricidad a partir de reacciones químicas. Cuando los dos electrodos de la celda están conectados a través de un camino cerrado, la celda fuerza a los electrones a fluir de un extremo al otro. El flujo de electrones hace que la corriente fluya en el circuito cerrado.

Capas de células secas
Con la ayuda de reacciones químicas, los electrones fluyen de un extremo al otro. Cuando dos o más células, conectadas con la polaridad correcta, fluyen más electrones debido al alto potencial. Esta combinación se llama batería. Desde un voltaje mínimo de 1,5 V a 100 V, se puede utilizar una batería para obtener un rango de voltajes. Incluso el voltaje de CC de salida de la batería se puede regular a diferentes niveles utilizando convertidores electrónicos de potencia como helicóptero circuitos.
Estructura de la celda
La estructura de la celda seca de zinc-carbono se muestra en la figura. Consiste en el ánodo terminal como zinc o en general varilla de grafito. El carbono forma la terminal del cátodo. Se puede observar que en versiones más antiguas de celda seca se usaba zinc como cátodo y grafito como terminal de ánodo. La selección de los elementos se basa fundamentalmente en su configuración química de la órbita más externa de los elementos.

Estructura de celda seca
Si tiene más electrones en la órbita más externa, entonces puede actuar como donante y, por lo tanto, forma el cátodo. De manera similar, si la órbita más externa tiene menos electrones, puede aceptar fácilmente y, por lo tanto, forma el ánodo. El electrolito colocado en el medio actúa como catalizador de las reacciones químicas. En general, utilizamos gelatina de cloruro de amonio como electrolito. En la figura que se muestra, el electrolito utilizado es una mezcla de zinc y cloruro. Además, el cloruro de sodio también se usa como electrolito. Alrededor de la barra del ánodo se rodea una mezcla de dióxido de manganeso y carbono.
Toda la configuración se coloca en un tubo de metal. Se evita que la gelatina se seque mediante el uso de una brea en la parte superior de la celda. Se coloca una arandela de carbono en la parte inferior. El propósito de esta arandela es evitar que la varilla del ánodo de zinc entre en contacto con el recipiente.
Esto también se llama espaciador como se muestra en el diagrama. La lata de zinc también está rodeada por papel aislante para fines de aislamiento. Para baterías grandes, también se utilizan otros materiales aislantes como mica, etc. El terminal positivo del ell se forma en la parte superior. El terminal negativo de la celda se forma en la base.
Trabajo de celda seca
Una celda seca trabaja fundamentalmente en reacciones químicas. Debido a las reacciones que tienen lugar entre el electrolito y los electrodos, los electrones fluyen de un electrodo a otro. Las sustancias como los ácidos se disuelven en agua para formar partículas ionizadas. La partícula ionizada es de dos tipos. Los iones positivos se denominan cationes y los iones negativos se denominan aniones. Los ácidos que se disuelven en agua se denominan electrolitos.
En el diagrama mencionado anteriormente, el cloruro de zinc se forma como electrolito. De manera similar, la gelatina de cloruro de amonio también se forma como electrolito. Las varillas de metal sumergidas en electrolitos forman electrodos. Con base en las características químicas de las varillas metálicas, tenemos un electrodo positivo como ánodo y un electrodo negativo como cátodo.
Los electrodos atraen los iones con carga opuesta a su lado. Por ejemplo, el cátodo atrae los aniones y el ánodo atrae los cationes. En este proceso, los electrones fluyen de una dirección a la otra, por lo que obtenemos un flujo de cargas. Se llama Actual .
Reacciones químicas
Las reacciones que tienen lugar en la celda se muestran a continuación. Primero está la reacción de oxidación.

En esto, el cátodo de zinc se oxida a iones de zinc cargados positivamente liberando dos iones. Estos electrones son recogidos por el ánodo. Luego viene la reacción de reducción.

La reacción de reducción en el ánodo se muestra arriba. Esta reacción produce una corriente eléctrica. Libera iones de óxido con óxido de magnesio. Esta reacción se forma cuando el magnesio se combina con el electrolito.


Las otras dos reacciones representan una reacción ácido-base y una reacción de precipitación que tiene lugar en la celda seca. En la reacción ácido-base, el NH se combina con OH para producir NH3 junto con agua. Los resultados son NH3 y base agua.
Diferencia entre una celda seca y una celda húmeda
La principal diferencia entre la celda seca y la celda húmeda es la forma del electrolito. Como se discutió anteriormente, en una celda seca, el electrolito, como el cloruro de amonio, es de naturaleza seca. Estas pilas secas son más comunes y se utilizan en juguetes, radios, etc. Pero en una pila húmeda, el electrolito está en estado líquido.
Se utilizan electrolitos líquidos como el ácido sulfúrico, que es un líquido corrosivo peligroso. Debido a la naturaleza de tales líquidos, la celda húmeda es de naturaleza más explosiva y debe manipularse con cuidado. La mejor ventaja de estas celdas húmedas es que se pueden recargar fácilmente y se pueden utilizar para numerosas aplicaciones. Tales baterías encuentran un uso común en la aviación, los servicios públicos, el almacenamiento de energía y las torres de telefonía celular.
Funciones de celda seca
La función de celda seca se basa en las reacciones químicas entre el electrodo y los electrolitos. Cuando los electrodos se colocan en los electrolitos, atrae los iones con carga opuesta hacia sí mismos. Esto provoca el flujo de cargas y, por tanto, se produce corriente.
Ventajas
los ventajas de la celda seca Incluya lo siguiente.
- La celda seca tiene numerosas ventajas como
- Es de tamaño pequeño.
- Puede venir en una variedad de niveles de voltaje.
- Es útil y tiene numerosas aplicaciones.
- Es la única fuente de voltaje CC.
- Se puede utilizar junto con circuitos electrónicos de potencia para regular el voltaje de salida.
- Es recargable.
Desventajas
los desventajas de la celda seca Incluya lo siguiente.
- Debe manejarse con cuidado
- Es explosivo
- Las baterías de gran capacidad son muy pesadas
Aplicaciones
los aplicaciones de la celda seca Incluya lo siguiente.
- Juguetes
- Aviación
- Celulares
- Radio
- Calculadora
- Relojes
- Audífonos
Por tanto, hemos visto el funcionamiento, la clasificación y las aplicaciones de la células secas . Un punto interesante que debe tenerse en cuenta es que la batería solo funciona cuando los electrodos están físicamente en contacto entre sí. Debe existir un medio conductor entre los dos electrodos. La pregunta es ¿se puede usar agua como medio conductor entre los electrodos de la celda seca? En ese caso, ¿qué pasará si esta celda se sumerge en agua?